-->
En un átomo, los electrones están girando alrededor del núcleo formando capas. En cada una de ellas, la energía que posee el electrón es distinta. En efecto; en las capas muy próximas al núcleo, la fuerza de atracción entre éste y los electrones es muy fuerte, por lo que estarán fuertemente ligados.
Ocurre lo contrario en las capas alejadas, en las que los electrones se encuentran débilmente ligados, por lo que resultará más fácil realizar intercambios electrónicos en las últimas capas.
Sin embargo los electrones no pueden escoger cualquier orbita que quieran. Ellos están restringidos a orbitas con solo ciertas energías. Los electrones pueden saltar de un nivel de energía a otro, pero ellos nunca pueden tener orbitas con otras energías distintas a los niveles de energía permitidos.
-->
El hecho pues, de que los electrones de un átomo tengan diferentes niveles de energía, nos lleva a clasificarlos por el nivel energético (o banda energética) en el que se encuentra cada uno de ellos.
En el modelo de Bohr la energía de un electrón dependía únicamente del número cuántico principal.
Lo mismo ocurre en la descripción de los orbitales atómicos en mecánica cuántica para el átomo de hidrógeno.

-->
Para átomos con más de un electrón (polielectrónicos) los orbitales atómicos tienen la misma forma que los orbitales del átomo de Hidrógeno, pero la presencia de más de un electrón afecta a los niveles de energía de los orbitales (debido a la repulsión entre dos electrones). Por esto la energía está determinada por el número cuántico principal y por el número cuántico secundario
Así por ejemplo el orbital 2s tiene un valor de energía menor que los orbitales 2p para átomos con más de un electrón:

-->
Efecto pantalla en átomos polielectrónicos
En un átomo polielectrónico cada electrón es simultáneamente:
¨ atraído por los protones del núcleo
¨ repelido por los otros electrones
Cualquier densidad electrónica presente entre el núcleo y el electrón reducirá la atracción que “siente” el electrón por parte del núcleo. A la carga neta positiva que atrae al electrón se le denomina carga nuclear efectiva.
La carga positiva que es sentida por los electrones más externos de un átomo es siempre menor que la carga nuclear real, debido a que los electrones internos apantallan dicha carga
En un átomo polielectrónico para un número cuántico dado (n) la carga efectiva, Zeff, disminuye al aumentar l
Como la energía del electrón depende de la carga efectiva los electrones con mayor carga efectiva, los del orbital 3s, tendrán menor energía que los electrones del orbital 3d.
En un átomo polielectrónico para un número cuántico dado (n) el nivel de energía del orbital aumenta al aumentar 
Nota: todos los orbitales de un subnivel tienen la misma energía.
Principio de Incertidumbre de Heisenberg:
Werner Heisenberg demostró que debido a las propiedades ondulatorias del electrón, no es posible conocer simultáneamente con certidumbre la posición y el momentum del electrón.
“Es imposible determinar simultáneamente la posición exacta y el momento exacto del electrón”
Principio de exclusión de Pauli
“Dos electrones del mismo átomo no pueden tener los cuatro números cuánticos idénticos (n, l, m y s) y por lo tanto un orbital no puede tener más de dos electrones”.
Como en un orbital atómico los valores de n, l, y m están fijados sólo podrán contener electrones que difieran en el valor de s. Ya que el número cuántico de espín sólo puede tomar dos valores (+1/2 y -1/2), un orbital atómico podrá estar ocupado como mucho por dos electrones que tengan valores de s opuestos.
La forma como están distribuidos los electrones de un átomo entre los distintos orbitales atómicos se denomina configuración electrónica
La configuración electrónica del átomo de un elemento corresponde a la ubicación de los electrones en los orbitales de los diferentes niveles de energía. Aunque el modelo de Scrödinger es exacto sólo para el átomo de Hidrógeno, para otros átomos es aplicable el mismo modelo mediante aproximaciones muy buenas.
Se puede llenar fácilmente la configuración electrónica de la mayor parte de los átomos de los elementos, siempre que se consideren las reglas siguientes:
· Saber el número de electrones que el átomo tiene; basta conocer el número atómico (Z) del átomo en la tabla periódica. Recuerda que el número de electrones en un átomo neutro es igual al número atómico (Z = p+).
· Ubicar los electrones en cada uno de los niveles de energía, comenzando desde el nivel más cercano al núcleo (n = 1).
· No se iniciará el llenado de un nuevo subnivel hasta que el subnivel energético anterior, de menor energía, se haya llenado completamente.
· Respetar la capacidad máxima de cada subnivel (s = 2e-, p = 6e-, d = 10e- y f = 14e-).
Ahora es posible describir la estructura electrónica de los átomos estableciendo el subnivel o distribución orbital de los electrones. Los electrones se colocan, primero, en los subniveles de menor energía, y cuando estos están completamente ocupados, se usa el siguiente subnivel de energía más alto. Esto puede representarse por la siguiente tabla:

-->
Este cuadro se ajusta estrictamente a la descripción hecha siguiendo el “principio de Aufbau”,
Este comportamiento no contradice aquello de que se llena primero el nivel de menor energía, luego el de mayor energía. Lo que aquí sucede es que hay superposición energética de niveles pues, por ejemplo, el subnivel 4s tiene menos energía que el 3d.
Tanto n como l contribuyen a la energía del subnivel, de modo que si el valor de l es suficientemente grande, la energía asociada al subnivel puede ser mayor que la correspondiente a otro subnivel, aunque este último posea un valor mayor de n. Sumando los valores numéricos de n y de l se puede determinar el orden de llenado.
4s se llena primero que 5d porque:
4s = 4 + 0 = 4 y 3d = 3 + 2 = 5
Sí esta suma fuera igual, regiría el menor valor de n.
Así, 4p se llena primero antes que 5s aunque la suma de los valores es igual.
4p = 4 + 1 = 5 y 5s = 5 + 0 = 5
Las dos excepciones al la regla anterior son 5d y 6d
Para encontrar la configuración electrónica se usa el mismo procedimiento anterior incluyendo esta vez el número máximo de electrones para cada orbital.
También podemos describir la distribución de electrones en el átomo de Litio como:
1s22s1
Esta es la llamada notación convencional
-->
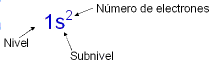
-->
Finalmente la Configuración queda de la siguiente manera:
1s2
|
2s2
|
2p6 3s2
|
3p6 4s2
|
3d10 4p6 5s2
|
4d10 5p6 6s2
|
4f14 5d10 6p6 7s2
|
5f14 6d10 7p6
|
Ejemplo:

-->
Este elemento tiene 3 electrones. Empezaremos llenando el orbital de menor energía con dos electrones que tendrán distinto s. El electrón restante ocupará el orbital 2s, que es el siguiente con menor energía:
La flecha indica el valor del cuarto número cuántico.
Los electrones que tienen números de espín opuestos cancelan los efectos magnéticos y se dice que son electrones apareados. Un ejemplo son los dos electrones que ocupan el orbital 1s en el átomo de Litio. De manera similar decimos que el electrón que ocupa el orbital 2s está desapareado.
PROPIEDADES MAGNÉTICAS DE LOS ÁTOMOS
Las propiedades magnéticas de una sustancia pueden revelar cierta información sobre el arreglo de los e- en un átomo o molécula. Como 1e- en un átomo actúa como un pequeño magneto, las atracciones magnéticas entre 2e- que tienen giros opuestos se cancelan una con la otra y como resultado un átomo que tiene todos los orbitales ocupados con los 2e- no tiene giro magnético neto. Sin embargo, un átomo en el cual hay e- sin parear exhibe un giro magnético neto, diferente de cero. Las propiedades magnéticas de un átomo se pueden observar, y de acuerdo a esto las sustancias se clasifican en:
1) Paramagnéticas: Son sustancias débilmente atraídas por un campo magnético y esta atracción generalmente es el resultado de e- sin parear.
2) Diamagnéticas: son sustancias que tienen todos los e- pareados y por lo tanto no son atraídas por un campo magnético.
Configuración Electrónica y la Tabla Periódica
En 1869 el químico ruso Dimitri Mendeleev propuso una tabulación más amplia de los elementos basada en la recurrencia periódica y regular de las propiedades. Este segundo intento de sistema periódico hizo posible la predicción de las propiedades de varios elementos que aún no habían sido descubiertos. Por ejemplo, Mendeleev propuso la existencia de un elemento desconocido que llamó eka–aluminio, cuya ubicación debiera ser inmediatamente bajo el aluminio. Cuando el galio fue descubierto cuatro años más tarde, se encontró que las propiedades predichas para el eka– aluminio coincidían notablemente con las observadas en el galio.
En 1913 Moseley ordenó los elementos de la tabla periódica usando como criterio de clasificación el número atómico. Enunció la “ley periódica”: "Si los elementos se colocan según aumenta su número atómico, se observa una variación periódica de sus propiedades físicas y químicas".
A partir de entonces la clasificación periódica de los elementos siguió ese criterio, pues en los átomos neutros el número de protones es igual al de electrones y existe una relación directa entre el último orbital ocupado por un e- de un átomo (configuración electrónica) y su posición en la tabla periódica.
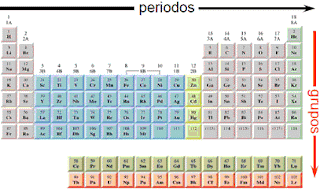
Actualmente la tabla está ordenada en:
Periodos.- un periodo es cada fila de la tabla. Actualmente hay siete filas horizontales que indican el último nivel enérgico que tiene un elemento.
Grupos.- Son cada una de las columnas de la tabla. Las 18 columnas (filas verticales) indican el número de electrones en la última capa.
Los elementos del mismo grupo tienen el mismo número de electrones en su capa más externa
-->
Clasificación periódica
De acuerdo con el tipo de subnivel que ha sido llenado, los elementos se pueden dividir en categorías:
¨ Elementos representativos,
¨ Gases nobles,
¨ Elementos de transición (o metales de transición),
¨ Lantánidos y
¨ Actínidos.

-->
Los elementos representativos son los elementos de los grupos 1A hasta 7A, todos los cuales tienen incompletos los subniveles s ó p del máximo número cuántico principal.
Con excepción del He, los gases nobles que conforman el grupo 8A tienen el mismo subnivel p completo.
Los metales de transición son los elementos 1B y del 3B hasta el 8B, los cuales tienen capas d incompletas, o fácilmente forman cationes con subniveles d incompletos.
Los elementos del grupo 2B son Zn, Cd, y Hg, que no son representativos ni metales de transición.
A los lantánidos y actínidos se les llama también elementos de transición interna del bloque f porque tienen subniveles f incompletos.
Se clasifica en cuatro bloques:
• Bloque “s”: A la izquierda de la tabla, formado por los grupos 1 y 2.
• Bloque “p”: A la derecha de la tabla, formado por los grupos 13 al 18.
• Bloque “d”: En el centro de la tabla, formado por los grupos 3 al 12.
• Bloque “f”: En la parte inferior de la tabla.

-->
La tabla periódica esta estructurada de manera que todos los átomos de una columna tienen los mismos electrones de valencia.
Así los metales alcalinos de la primera columna tienen todos un electrón de valencia en un orbital s, ó el grupo de los halógenos que tienen 7 electrones de valencia: dos en el orbital s y 5 en los tres orbitales p. Si agrupamos las columnas en función del último tipo de orbital que se ha llenado tendremos:

-->
· A la izquierda, en lila, están los metales alcalinos y alcalinotérreos, donde se están llenando los orbitales s.
·
A mano derecha, en verde, están los grupos del 13 al 18, en los cuales se están llenando los orbitales p.
· En la mitad de la tabla periódica, en color amarillo, están los metales de transición, en los cuales se están llenando los orbitales d.
· Debajo de los metales de transición están las dos filas de elementos en los cuales se están llenando los orbitales f; los lantánidos y los actínidos.
LOCALIZACIÓN DE LOS ELEMENTOS
1º periodo (línea 1): el primer nivel de energía consta de un solo orbital atómico, 1s. Éste puede contener como máximo dos electrones.
El hidrógeno tiene un solo electrón.
El helio, un gas noble, tiene el primer nivel de energía lleno. Este es tan estable que se sabe que no participa en ninguna reacción química.

-->
El principio aufbau o de construcción
Sólo se pueden ocupar los orbitales con un máximo de dos electrones, en orden creciente de energía orbital: los orbitales de menor energía se llenan antes que los de mayor energía.
En su estado fundamental la distribución electrónica de un elemento se construye a partir del inmediato anterior, adicionándole un electrón de modo que le confiera la máxima estabilidad (menor energía).
2º Periodo (línea 2): Los elementos del número atómico 3 al 10 ocupan el segundo periodo o línea horizontal de la tabla periódica. El segundo nivel de energía se encuentra completamente lleno en los átomos de Neón. El Neón es un gas noble extremadamente estable; se sabe que no participa en ninguna reacción.

-->
Para el Boro el quinto electrón se sitúa en un orbital 2p y al tener los tres orbitales 2p la misma energía no importa cuál de ellos ocupa.
En el carbono el sexto electrón podría ocupar el mimo orbital que el quinto u otro distinto.
Regla de Máxima Multiplicidad de Hund
La distribución más estable de los electrones en los subniveles es aquella que tenga el mayor número de espínes paralelos.
P = 2S+1 Donde: S=∑ l
Se aplica la regla de Hund de máxima multiplicidad cuando un orbital p, d, o f es ocupado por más de un electrón.
Esta regla dice que los electrones permanecen sin aparear con espines paralelos en orbitales de igual energía, hasta que cada uno de estos orbitales tenga, cuando menos un electrón.
Supongamos 2 electrones en los orbitales p, existen dos posibilidades

-->
Los electrones se repelen entre sí y al ocupar distintos orbitales pueden situarse más lejos uno del otro.
El Neón completa el nivel dos y al igual que el Helio tiene una configuración estable.
3º Periodo (línea 3): El siguiente elemento después del Neón es el Sodio. En él se comienza a añadir electrones al tercer nivel de energía. Los elementos del 11 al 18 ocupan el tercer periodo de la tabla periódica.
Las configuraciones electrónicas pueden también escribirse de manera abreviada escribiendo el símbolo del gas noble que le precede entre corchetes, seguido de los electrones presentes por encima del gas noble.
A los electrones que pertenecen a un nivel incompleto se les denomina electrones de valencia.

-->
Aunque el tercer nivel de energía aún no se encuentra lleno (los orbitales d están vacíos), el argón es un gas noble.
Todos los gases nobles con excepción del Helio tienen configuraciones electrónicas ns2 np6 (en donde n indica el nivel de energía más alto que se encuentra ocupado).
Los gases nobles son elementos que reaccionan muy poco.
4º Periodo (línea 4): Es un hecho observado de manera experimental que el electrón ocupa el orbital de energía inferior disponible. En la mayoría de los átomos el orbital 4s se llena antes que los electrones penetren a los orbitales 3d.
Cuando el subnivel 3d se encuentra lleno a toda su capacidad de 10 electrones comienza a llenarse los orbitales 4p, como ocurre en el gas noble Kriptón.
A continuación se examinarán las estructuras electrónicas de los 18 elementos de cuarto periodo, en detalle. Algunos tienen electrones en orbitales d.

-->
Al estudiar estas configuraciones electrónicas, se puede ver cómo la mayoría de ellas se predicen según el principio de Aufbau.
Algunos conjuntos de orbitales tienen energía tan cercana (por ejemplo, los 4s y 3d), que los cambios de tipo menor en sus energías relativas pueden ocasionar en ciertos casos un cambio en el orden de llenado.
La evidencia química y espectroscópica indican que las configuraciones del Cr (Z = 24) y Cu (Z = 29) tienen un solo electrón en el orbital 4s. Sus conjuntos 3d están semillenos y llenos respectivamente, en el estado basal. Los cálculos de ecuaciones de mecánica cuántica indican también que los conjuntos semillenos y llenos de orbitales equivalentes tienen su estabilidad mayor especial, puesto que su energía es más baja.
Los subniveles semillenos y totalmente llenos son mucho más estables que los parcialmente llenos.
Las configuraciones d5 y d10 son más estables que las parcialmente llenas. Debido a la elevada energía de intercambio (tratamiento mecánico cuántico) que está implicada.
Aparentemente, este incremento de estabilidad basta para hacer que la energía de los orbitales 3d sea inferior a la orbital 4s.
Cr: [Ar] 3d54s1
Ag: [Kr] 4d105s1
Cu: [Ar] 3d104s1
Mo: [Kr] 4d55s1
Au: [Xe]4f14 5d106s1
Pd: [Kr] 4d10


-->
Puede parecer sorprendente que no se produzca este tipo de excepción en, por ejemplo, Ge (Z = 32) o Si (Z = 14), en cuyo caso podría existir una configuración s1p3 con conjuntos semillenos orbitales s y p; pero esto no sucede debido a la energía considerable que separa a los orbitales ns y np.
5º Periodo (línea 5): A continuación, se llena el orbital 5s, los cinco orbitales 4d y los tres orbitales 5p, hasta llegar al xenón, otro gas noble.

-->
A partir del Cerio (elemento 58) se empiezan a llenar los orbitales 4f que pueden albergar en su conjunto 14 electrones. Estos elementos adicionales vienen después del Lantano y forman la serie de los lantánidos o tierras raras, que son elementos con los subniveles 4f incompletos o que producen fácilmente cationes con los subniveles 4f incompletos. Las energía de los orbitales 5d y 4f están muy próximas y así el lantano tiene la configuración electrónica [Xe]6s2 5d1 y el cerio [Xe]6s2 5d14f1
Después del Actino ([Rn]7s2 6d1) viene la serie de los actínidos que empieza con el Torio ([Rn]7s2 6d15f1) dónde la mayoría de los elementos no se encuentran en la naturaleza sino que se han sintetizado.
By pass
Un gran numero de elementos de transición interna presentan este fenómeno, donde el subnivel <> debe hacer transición al próximo subnivel <>
92U:(81Rn)7s2, 5f4 : es incorrecto
92U:(81Rn)7s2, 5f3, 6d1 : es correcto
64Gd:(54Xe)6s2, 4f8 : es incorrecto
64Gd:(54Xe)6s2, 4f7, 5d1 : es correcto.
Si tuvieran alguna consulta adicional u otro ejercicio en el que necesiten ayuda, mi e-mail es jwzq2005@gmail.com con gusto los atenderé.
No hay camino hacia la verdad, la verdad es el camino.
(Mahatma Gandhi)

