Hemos recibido la siguiente consulta sobre enlace químico que trataremos de aclarar de forma de que se entienda fácilmente.
Como identificar químicamente un elemento Covalente, Polar, No Polar, Iónico, Metálico, si solo me dan una tabla periódica y me ponen a clasificar esos elementos ¿Como se hace?
Por favor basarse en estos ejemplos:
H2
H3PC4
P4
H2SO4
H3PC4
P4
H2SO4
Lo básico para identificar ante que tipo de enlace nos encontramos es saber el tipo de material que interviene:
Metal + No metal ===> Compuesto Iónico
No metal + No metal ===> Compuesto Covalente
Metal + Metal ===> Compuesto metálico
También podemos utilizar las electronegatividades de los elementos
Diferencia de electro-negatividad (∆EN)
|
Tipo de enlace
|
Covalente apolar
| |
Covalente polar
| |
Mayor a 1,7
|
Iónico
|
Empezaremos diciendo que los enlaces químicos se clasifican de la siguiente forma:
Enlaces Interatómicos:
Enlaces Interatómicos:
¨ Enlace covalente
¨ Enlace Iónico o electrovalente
¨ Enlace metálico
Enlace covalente
Los compuestos covalentes se forman cuando se combinan dos o más no metales. Estos átomos tienen muchos electrones en su nivel más externo (electrones de valencia) y tienen tendencia a ganar electrones más que a cederlos, para adquirir la estabilidad de la estructura electrónica de gas noble. Por tanto, los átomos no metálicos no pueden cederse electrones entre sí para formar iones de signo opuesto.
Este tipo de enlace se produce cuando existe electronegatividad polar y se forma cuando la diferencia de electronegatividad no es lo suficientemente grande como para que se efectúe la transferencia de electrones.
No metal + No metal ===> Compuesto Covalente
Tipos de enlace covalente:
I.- Según el número de electrones aportados para formar el par electrónico enlazante:
I.1.- Covalente normal. En este tipo de enlace, cada átomo aporta un electrón para formar el par electrónico enlazante, por lo tanto se efectúa en orbitales desapareados.

I.2.- Covalente coordinado o dativo. Consiste en que el par de electrones enlazante es aportado por un solo átomo. En la representación de un compuesto empleando fórmulas desarrolladas el enlace covalente coordinado se indica mediante una flecha (→) apuntando hacia quien recibe el par electrónico de enlace, el H2SO4, H3PO4 y el HNO3 presentan este tipo de enlace. El átomo que aporta el par de electrones se denomina dador, y el que lo recibe, receptor.

Estructura del Ácido Sulfúrico, H2SO4
Para escribir la fórmula electrón-punto del ácido sulfúrico, H2SO4, se pueden seguir los siguientes pasos:
Paso 1: Calcule el número total de electrones externos.
1 átomo de S = 6 e-
4 átomos de O = 24 e-
2 átomos de H = 2 e-
H2SO4 = 32 e- externos
Cada uno de los átomos de oxígeno tiene 6 electrones exteriores, 1 átomo de azufre tiene 6 electrones externos y 2 átomos de hidrógeno tienen 2 electrones externos, por lo tanto, hay un total de 32 electrones exteriores.
Paso 2: Identifique el átomo central y escriba todos los demás átomos a su alrededor, conectados a éste con un enlace covalente.
El átomo central es el azufre. Escriba los átomos de hidrógeno unidos a dos de los oxígenos.

Paso 3: Coloque los electrones restantes en la estructura de punto de tal manera que todos los átomos en la molécula obtengan una configuración de un gas noble.

En la estructura del ácido sulfúrico, observamos los electrones color rojo entre el azufre y el oxígeno superior y el azufre y el oxígeno inferior. Estos electrones pertenecen al azufre. Aquí se produce una situación especial que corresponde a la formación de un enlace covalente dativo o coordinado que por definición es: aquel enlace covalente en el que el par de electrones compartidos es suministrado sólo por uno de los átomos enlazados. Esto se puede representar de las siguientes formas:

El ácido sulfúrico tiene dos enlaces covalentes dativos.
Paso 4: Verifique se ha colocado el número adecuado de electrones en la estructura y si cada átomo tiene la configuración de un gas noble.
Estructura del Ácido Fosfórico, H3PO4
Para escribir la fórmula electrón-punto del ácido fosfórico
-->, H3PO4, se pueden seguir los siguientes pasos:
Paso 1: Calcule el número total de electrones externos.
1 átomo de P = 5 e-
4 átomos de O = 24 e-
3 átomos de H = 3 e-
H3PO4 = 32 e- externos
Cada uno de los átomos de oxígeno tiene 6 electrones exteriores, 1 átomo de fósforo tiene 5 electrones externos y 3 átomos de hidrógeno tienen 1 electrón externo, por lo tanto, hay un total de 32 electrones exteriores.
Paso 2: Identifique el átomo central y escriba todos los demás átomos a su alrededor, conectados a éste con un enlace covalente.
El átomo central es el fósforo. Escriba los átomos de hidrógeno unidos a tres de los oxígenos.

Paso 3: Coloque los electrones restantes en la estructura de punto de tal manera que todos los átomos en la molécula obtengan una configuración de un gas noble.
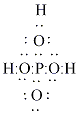
En la estructura del ácido fosfórico hay un enlace covalente dativo, por lo que al utilizar líneas se puede representar de las siguientes formas:

El ácido fosfórico tiene un enlace covalente dativo.
Paso 4: Verifique se ha colocado el número adecuado de electrones en la estructura y si cada átomo tiene la configuración de un gas noble.
II.- Según el número de pares electrónicos enlazante:
II.1.- Covalente simple. Cuando hay un solo par electrónico enlazante entre los átomos.
Su esquema general sería el siguiente:

II.2.- Covalente múltiple, Cuando hay dos o más pares electrónicos enlazante entre dos átomos
Su esquema general sería el siguiente:

Polaridad y apolaridad de de enlace
1.- Enlace covalente polar
Es aquel enlace que surge entre los átomos no metálicos de elementos diferentes, donde la comparación del par electrónico enlazante no es equitativo (es desigual), esto es debido a que uno de los átomos es más electronegativo que el otro. Esta discrepancia en la compartición de los electrones de enlace origina una polaridad eléctrica en los átomos; así, el átomo más electronegativo atrae con mayor fuerza los electrones compartidos, por lo que posee mayor densidad electrónica, presentando una carga parcial negativa (-∂) y el átomo menos electronegativo presenta una carga parcial positiva (+∂).

Enlace Covalente en el Cloruro de Hidrógeno, HCl
Cuando un átomo de H se una a un átomo de Cl, se produce un enlace covalente polar simple:

En el cloruro de hidrógeno
--> se comparten un electrón del átomo de H y un electrón del átomo de Cl, lo cual da al H y al Cl la configuración estable de gas noble. Sin embargo, puesto que la electronegatividad del Cl (3.0) es mayor que la electronegatividad del H (2.1), el átomo de Cl atrae con mayor fuerza el par de electrones compartidos que el átomo de H. Esta atracción desigual produce un dipolo en la molécula. Existe un dipolo cuando hay una separación cargas. 
La delta se lee como parcial. Es decir, δ- significa que un átomo tiene una carga parcial negativa y δ+ significa que un átomo tiene una carga parcial positiva.
Las moléculas polares se atraen entre sí con mayor fuerza que las moléculas no polares similares.
Las fuerzas de atracción entre las moléculas polares covalentes juegan un papel importante en los seres vivos.
La polaridad del enlace también se indica por medio de una flecha con cruz dirigida hacia el centro de carga más negativo.
2.- Enlace covalente apolar o no polar
Consiste en la compartición equitativa (o igual) de los electrones enlazantes entre dos átomos, por lo que no surgen polos permanentes. Se observa este tipo de enlace cuando dos átomos de un mismo elemento o átomos de igual electronegatividad se unen para formar una molécula, sin carga eléctrica, simétrica y cuya diferencia de electronegatividad está entre 0 y 0.5. Así por ejemplo las moléculas diatómicas, H2, N2, O2, F2, Cl2, Br2, I2.

Enlace Covalente en las Moléculas de Hidrógeno
El gas hidrógeno está compuesto de moléculas de H2 y no de átomos de H separados. Una molécula compuesta de dos átomos se denomina molécula diatómica.
Cuando un átomo de H se enlaza a otro átomo de H para formar un enlace sigma, no puede ocurrir transferencia porque cada átomo de H tiene la misma capacidad de atraer electrones. En otras palabras, los dos átomos de H tienen la misma electronegatividad. En su lugar, los átomos de H comparten sus electrones para adquirir la configuración estable del gas noble de dos electrones (isoelectrónica con el He). Se puede decir que los electrones compartidos pertenecen a ambos átomos simultáneamente.

Los enlaces covalentes se producen cuando el orbital del nivel exterior de otro átomo se superpone con el orbital del nivel exterior de otro átomo. En el H2, el orbital 1s del átomo de hidrógeno, se superpone con el orbital 1s de otro átomo de hidrógeno. Los orbitales superpuestos son regiones entre dos núcleos donde hay una alta probabilidad de encontrar electrones. Los enlaces covalentes, al igual que los enlaces iónicos, se producen por atracción entre partículas positivas (núcleos) y partículas negativas (electrones en los orbitales superpuestos).
En este ejemplo ambos átomos son iguales en su electronegatividad, por lo tanto, ninguno de los dos átomos tiene una fuerza de atracción mayor hacia el par de electrones compartido. Este tipo de enlace se conoce como enlace covalente no polar.


Podemos utilizar ahora la diferencia de electronegatividad para predecir el tipo de enlace que se presenta entre los átomos:
Diferencia de electronegatividad (∆EN)
|
Tipo de enlace
|
Covalente apolar
| |
Covalente polar
| |
Mayor a 1,7
|
Iónico
|
La electronegatividad de los elementos del mismo periodo aumenta de izquierda a derecha y en los grupos se observa que el aumento es de abajo hacia arriba.

Enlace Electrovalente o Iónico
Enlace iónico es una fuerza electrostática de atracción entre un catión y un anión que se forman previa transferencia de electrones de valencia. Ocurre cuando hay transferencia completa de electrones de un átomo a otro.
El átomo que pierde electrones se transforma en ión positivo o catión y el que acepta se convierte en ión negativo o anión. El número de electrones perdidos o ganados determina la valencia del elemento.
La fuerza de atracción de iones de distinta carga es de carácter electrostático y por eso el enlace también se llama electrovalente.
Este enlace se forma por la transferencia de uno o varios electrones de un elemento metálico (poco electronegativo) (especialmente los situados más a la izquierda en la tabla periódica –períodos 1, 2 y 3) a uno no metálico (muy electronegativo) (los elementos situados a la derecha en la tabla periódica –especialmente los períodos 16 y 17).
Metal + No metal ===> Compuesto Iónico
Características del enlace iónico
1.- Generalmente se efectúa entre un elemento metálico y uno no metálico.
Se presentan los casos más importantes de excepción:
BeCl2, BeO, BeF2,BeBr2,BeI2 y AlCl3 No poseen enlaces iónicos, son covalentes, a pesar de que están formados por átomos metálicos y no metálicos.
NH4Cl, NH4NO3, (NH4)2SO4, etc. Son compuestos iónicos, poseen enlaces iónicos a pesar de que están formados sólo por átomos no metálicos.
2.- En compuestos binarios, si la diferencia de electronegatividades (∆EN) es mayor o igual a 1,7 el enlace es iónico.

Ejemplo: La sal común se forma cuando los átomos del gas cloro se ponen en contacto con los átomos del metal sodio.

Cuando se transfieren electrones de un elemento metálico a uno no metálico, existe una atracción electrovalente entre el catión y el anión lo cual produce un compuesto de tipo iónico y cuya estructura generalmente es cristalina, como es el caso del sodio y la el cloro que por sus distribuciones electrónicas buscan una mayor estabilidad formando una sal donde cada ión de cloro esta rodeado por seis cationes de sodio y cada sodio rodeado por seis aniones de cloro.
Mediante una transferencia de un electrón al cloro de cada sodio adquiere la distribución del neón Na[Ne]3s1 ®Na+ [Ne]+ e-
Mediante la transferencia de un electrón del sodio, el cloro adquiere la distribución del argón Cl[Ne]3s23p5 + e- ®Cl- [Ar]
La reacción entre el sodio sólido y el cloro gaseoso es espontánea, la transferencia de electrones entre el metal y el no metal esta asociada a un calor de formación del NaCl (s) y presenta las etapas de cambio del sodio de sólido a gas con un cambio de = 92kJ por la nergia necesaria para el cambio de estado , luego en el proceso existe un paso de moléculas de cloro a átomos de cloro y para romper dicho enlace se requieren = 121 kJ ; la ionización del sodio al pasar de sodio gaseoso a ion sodio gaseoso Na+ requiere de = 496 kJ ( energía de ioniozación) y la adición de un electrón al cloro gaseoso requiere de = -349 kJ (afinidad electrónica). La combinación final de los iones tiene un cambio de = -771.
Enlace metálico
Se presenta en los metales y aleaciones al construir cristales metálicos, Es el enlace que se da entre elementos de electronegatividades bajas y muy parecidas, en estos casos ninguno de los átomos tiene más posibilidades que el otro de perder o ganar los electrones. La forma de cumplir la regla de octeto es mediante la compartición de electrones entre muchos átomos. Se crea una nube de electrones que es compartida por todos los núcleos de los átomos que ceden electrones al conjunto..
Este tipo de enlace se produce entre elementos poco electronegativos (metales).
Metal + Metal ===> Compuesto metálico
El enlace metálico es un enlace que ocurre entre los átomos de metales y tiene características muy específicas. Consiste en un conjunto de cargas positivas que son los Kernels de los átomos metálicoas y los electrones periféricos pertenecen a todos los cationes, es decir, los átomos se encuentran unidos entre sí por una nube de electrones de valencia que rodea a los Kernel.
Los conductores por excelencia son los metales. Estos forman redes de iones en los que cada átomo cede sus electrones de valencia para formar una nube de electrones libres. La nube negativa hace de aglutinante de los iones positivos, apantallando la repulsión y manteniéndolos unidos. En la Figura siguiente se muestra de manera simplificada, la red de átomos del aluminio.

Si tuvieran alguna consulta adicional u otro ejercicio en el que necesiten ayuda, mi e-mail es jwzq2005@gmail.com con gusto los atenderé.
Nuestra recompensa se encuentra en el esfuerzo y no en el resultado. un esfuerzo total es una victoria completa.
GANDHI, Mohandas

